Pipeline
Emcitate® (tiratricol)
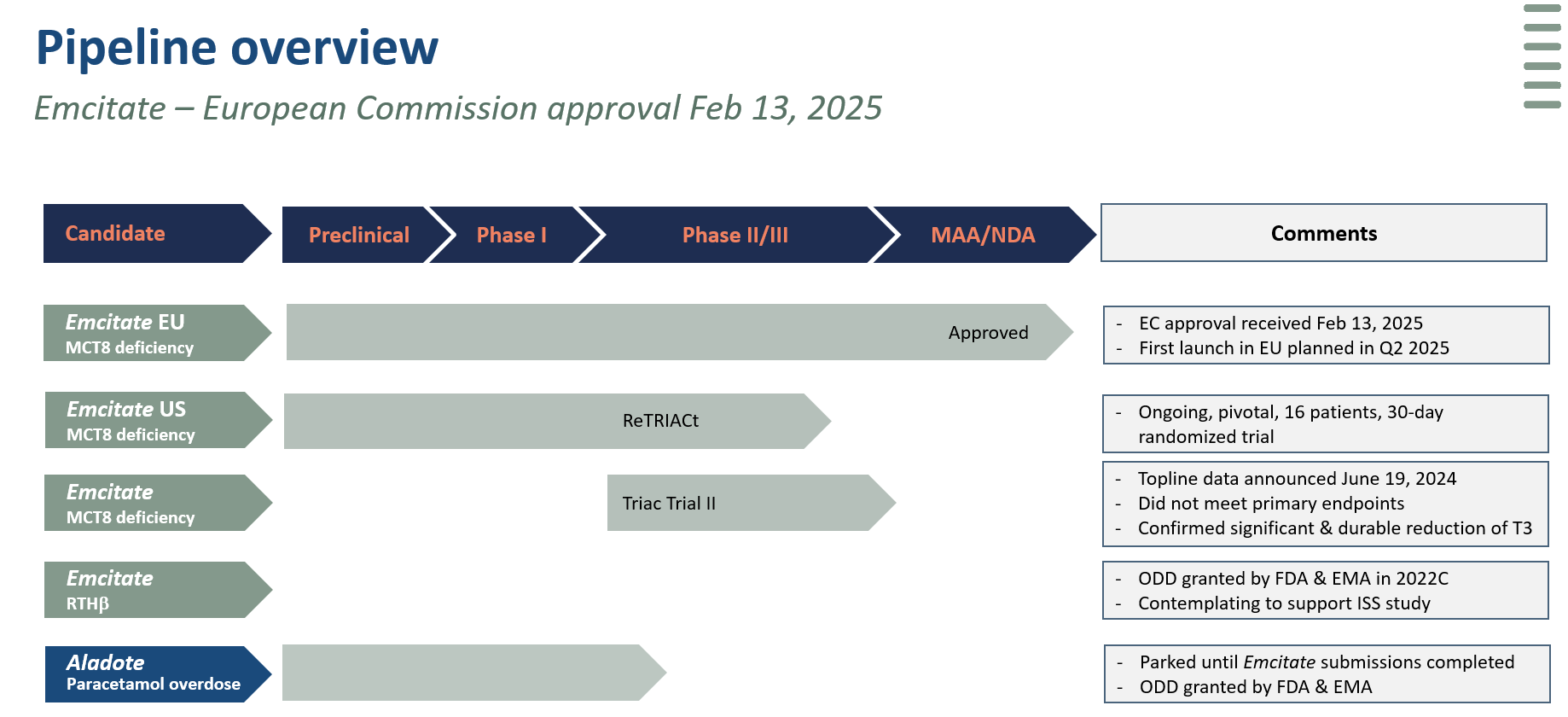
Emcitate är en läkemedelskandidat som utvecklas som den potentiellt första behandlingen för patienter med MCT8-brist, en sällsynt sjukdom med ett stort medicinskt behov och ingen tillgänglig behandling. En klinisk fas IIb-studie (Triac Trial I) samt en kohortstudie har genomförts med signifikanta och kliniskt relevanta behandlingsresultat på serum T3-halter och kliniskt relevanta sekundära effektmått. Som ett resultat av diskussioner med den europeiska läkemedelsmyndigheten (EMA) ansökte Egetis om marknadsgodkännande för Emcitate till EMA i oktober 2023. Den 12 december 2024 erhöll Egetis ett positivt CHMP-utlåtande för Emcitate för behandling av MCT8-brist.
I USA genomför Egetis efter dialog med FDA en bekräftande randomiserad, placebokontrollerad studie på minst 16 utvärderbara patienter för att verifiera resultaten på T3-nivåer i tidigare kliniska prövningar och publikationer. Egetis kommer att uppdatera marknaden så snart rekryteringen har slutförts, och vid det tillfället informera om när topline resultat förväntas och när NDA-ansökan därav kan förväntas lämnas in. Triac Trial II är en studie på 22 mycket unga patienter med MCT8-brist (<30 månader gamla) som undersökte neurokognitiva effekter av tidig intervention med tiratricol. Top-line resultat presenterades i juni 2024. Studien uppvisade inte statistiskt signifikant förbättring jämfört med historiska kontroller. Studien bekräftade att behandling med tiratricol ger signifikant och varaktig minskning av endogena T3-koncentrationer hos alla patienter och den gynnsamma säkerhetsprofilen av tiratricol som setts i tidigare kliniska studier, trots högre dosering per kg kroppsvikt.
Tiratricol har särläkemedelsstatus (’orphan drug designation’, ODD) i USA och EU för MCT8-brist och RTH-beta. MCT8-brist och RTH-beta är separata indikationer utan överlapp i patientpopulationerna. I USA har tiratricol även beviljats Rare Pediatric Disease Designation (RPDD) vilket ger Egetis möjligheten att erhålla en Priority Review Voucher (PRV), efter marknadsgodkännande.
Calmangafodipir (Aladote®)
Calmangafodipir är en ”first-in-class” läkemedelskandidat som utvecklas för att minska akuta leverskador till följd av paracetamolförgiftning. En ”proof of principle”-studie (fas Ib/IIa) har slutförts. Utformning av den pivotala fas IIb/III-studien för calmangafodipir har slutförts efter interaktioner med FDA, EMA och MHRA. Calmangafodipir har beviljats särläkemedelsstatus i USA och EU.